Tests sérologiques : les coulisses d’une validation controversée à 7 millions (enquête)

Les Belges bénéficient-ils des meilleurs tests pour détecter leur immunité contre le Covid-19 ? Au meilleur prix ? Pas certain au vu du nouveau bras de fer qui oppose l’Agence fédérale des médicaments et les labos cliniques, sur fond de conflit d’intérêts autour d’un test italien controversé qui va coûter des millions au contribuable. Thierry Denoël et David Leloup, en collaboration avec Knack.
La Belgique détient-elle le record de bourdes dans la gestion du matériel de protection et des tests de dépistage pour le Covid-19 ? Après la révélation, par Le Vif/L’Express, de la destruction par Maggie De Block (Open VLD), l’an dernier, du stock stratégique qui n’a pas été renouvelé, la saga des masques n’a cessé de rebondir. Mais c’est aussi le règne de la confusion, au niveau du dépistage. Une polémique a éclaté, en avril dernier, à propos des tests PCR de détection du virus entre les laboratoires de biologie clinique, qui regrettent d’avoir été mis sur le côté, et la task force « testing », placée sous la houlette du ministre Philippe De Backer (Open VLD), qui a confié ces tests à un consortium d’entreprises pharmaceutiques. On pensait que, pour les tests sérologiques, permettant de voir si on a développé des anticorps contre le coronavirus, les leçons auraient été tirées. Il n’en est rien.
Le Vif/L’Express et Knack révèlent les dessous d’une nouvelle polémique qui a éclaté entre nombre de labos cliniques et l’Agence fédérale des médicaments et produits de santé (AFMPS) à propos, cette fois, de ces tests sérologiques et de leur validation pour être mis sur le marché et remboursés. En cause : la mainmise absolue de l’agence et particulièrement d’un de ses trois directeurs généraux, Hugues Malonne, DG Post-Autorisation, qui fait partie de la task force de De Backer.
L’AGENCE DES MÉDICAMENTS A VOULU TOUT CONTRÔLER, LES CONTRATS, LA VALIDATION DES TESTS…
Pour ces tests « séro », l’AFMPS a pris les devants en négociant elle-même des contrats avec les firmes productrices et a imposé, avec Sciensano, une procédure de validation tout à fait inédite des tests qui bénéficiaient pourtant déjà du marquage de conformité européenne (CE).
Tout contrôler
« Habituellement, les firmes envoient des représentants dans les labos et ceux-ci valident eux-mêmes les kits sérologiques avant d’en commander en quantité, précise Etienne Cavalier, président de la Société royale belge de médecine de laboratoire. Il faut savoir que les laboratoires sont agréés selon des critères très stricts et qu’ils partagent leurs résultats pour mieux « challenger » les firmes. La biologie clinique est un vrai métier, avec cinq ans de formation après la pharma ou la médecine. Ici, l’AFMPS a voulu tout contrôler, y compris les validations, ce qui est contraire à l’arrêté royal du 31 décembre 1999 qui définit la qualité des labos de biologie clinique. »

Bien sûr, il fallait à tout prix éviter les écueils rencontrés avec les tests PCR. « Notre préoccupation était de sécuriser des stocks de tests sérologiques, souligne Hugues Malonne. La firme italienne DiaSorin était une des toutes premières à proposer son produit et surtout à pouvoir nous garantir un volume. J’ai négocié avec elle début avril. » Un million de tests, au prix de sept euros l’unité. De manière inattendue, l’AFMPS a également voulu contrôler la validation des tests, en arguant que même ceux marqués CE n’offraient pas toujours une fiabilité prouvée. En réalité, l’agence outrepassait ses prérogatives. Elle a alors publié une liste de tests « recommandés » (après validation). Libre aux labos de faire leur choix dans cette liste. Mais seuls les tests recommandés sont remboursés par l’Inami… C’est donc bien une validation officielle, mais qui ne dit pas son nom.
Conflit d’intérêts ?
L’histoire ne s’arrête pas là. L’AFMPS a confié la validation de chaque test sérologique à des laboratoires précis. Parmi ceux-ci, le labo des Hôpitaux Iris-Sud (HIS) de Bruxelles (qui réunissent les cliniques Baron Lambert, Molière Longchamp, Etterbeek-Ixelles et Joseph Bracops), dont la directrice adjointe, Marie Tré-Hardy, n’est autre que… l’épouse du DG de l’AFMPS Hugues Malonne. Le labo des HIS, non universitaire, a été chargé de valider trois tests dont le DiaSorin – le premier négocié par l’agence – et l’allemand EuroImmun. Cela serait moins interpellant si le LHUB-ULB, le plus grand labo hospitalier du pays réunissant les hôpitaux universitaires de Bruxelles (Erasme, Bordet, Saint-Pierre, Brugmann, Huderf), avait été, lui aussi, formellement sollicité par l’AFMPS. Mais cela n’a pas été le cas : « L’AFMPS ne nous a jamais mandatés pour réaliser la moindre validation officielle d’un test sérologique pour le Covid-19 », déclare Béatrice Gulbis, directrice médicale du LHUB-ULB. « Nous n’avons réalisé aucune étude de validation à la demande de l’AFMPS », déclare également Pieter Vermeersch du service de médecine de laboratoire à l’UZ Leuven.
Au LHUB-ULB, on précise que l’AFMPS a repris sur sa liste de tests recommandés certaines de leurs validations réalisées de leur propre initiative, ce qui a suscité une certaine surprise au sein du laboratoire. Idem pour l’UZ Leuven, le labo de référence pour les analyses concernant le coronavirus. Hugues Malonne assure qu’il n’a voulu privilégier personne et que sa femme est, de toute façon, couverte par sa déclaration de conflit d’intérêts à l’AFMPS. « Quel est le bénéfice du labo sélectionné qui réalise cette validation sans être rémunéré ? » s’étonne-t-il. Marie Tré-Hardy est tout de même première auteure de l’article de validation des kits DiaSorin et EuroImmun publié le 25 mai dans la revue Clinical Chemistry & Laboratory Medicine (CCLM). Le premier auteur est celui à qui le travail a été confié et qui a réalisé la majeure partie de la recherche. Elle n’avait plus rien signé depuis deux ans et demi, si ce n’est un article en tant que quatrième auteur, en 2019, sur un autre produit DiaSorin.
Pour un scientifique, c’est important : les carrières se bâtissent sur les publications. « La revue CCLM est le journal avec le plus gros facteur d’impact dans le secteur de la biologie médicale, note Etienne Cavalier. Nous sommes jugés sur nos publications, dans un milieu assez compétitif. » Marie Tré-Hardy, elle, s’en défend : « Ces publications ne vont pas booster ma carrière. J’ai le titre de professeure détachée et je suis au maximum des cours que je peux donner à l’ULB et à l’UNamur. » La biologiste clinique n’a pas le sentiment d’avoir été favorisée par son mari : « Une quarantaine de tests ont été répartis dans différents laboratoires en Belgique, universitaires, non universitaires, néerlandophones, francophones… Je n’en ai testé que trois. La KULeuven (NDLR : le labo de l’UZ Leuven) bat tous les records : ils en ont testé onze, je pense. L’AFMPS leur a confié des évaluations au tout début, ainsi qu’au LHUB qui en a eu six ou sept, bien avant moi. » Une version que démentent donc le LHUB-ULB et l’UZ Leuven…
Plus gênant encore : l’AFMPS a carrément interdit à l’ensemble des laboratoires cliniques d’évaluer eux-mêmes, comme ils le font habituellement, des tests dont la validation avait officiellement été confiée à l’un d’entre eux. Cette mesure les a donc empêchés, dans le même temps, de publier leurs résultats dans des revues scientifiques. Du jamais-vu dans le petit monde des labos cliniques. « On étouffe notre liberté académique », s’insurge un biologiste qui ne comprend pas pourquoi l’AFMPS les bride de cette façon en leur défendant de comparer des produits entre eux.
Etrange signature
L’histoire n’est pas terminée. Le 24 avril, lors d’une vidéoconférence réunissant 120 biologistes cliniques, Malonne affirme, sans les montrer, que les résultats de performance du test DiaSorin atteignent près de 100 % au niveau de la sensibilité et de la spécificité. Et il encourage à l’utiliser. Comme l’atteste l’article de validation publié un mois plus tard, son épouse vient juste de mesurer ces deux critères de performance sur le test italien. La sensibilité se définit par le pourcentage de patients positifs au test PCR (virus identifié dans un prélèvement nasal) chez qui des anticorps sont ensuite détectés dans le sang. La spécificité, elle, correspond au pourcentage de sujets non malades, chez qui les échantillons ont été prélevés avant l’apparition du Covid-19, et qui ont un test sérologique négatif. Plus le test est sensible, moins il produira de faux résultats négatifs. Plus il est spécifique, moins il produira de faux positifs.
Le DiaSorin, dont l’AFMPS a commandé un million de tests, est-il si performant que cela ? Les labos cliniques peuvent-ils en commander les yeux fermés, sur les recommandations d’Hugues Malonne ? En tout cas, de façon inattendue, DiaSorin a entrepris de leur envoyer des kits, sans qu’ils n’aient rien demandé. Ceux qui n’en veulent pas doivent les renvoyer.
Mais, le 15 mai, un autre article de Marie Tré-Hardy en tant que première auteure, concernant le test DiaSorin, est publié dans le Journal of Infection, cette fois. Les coauteurs sont les mêmes que ceux qui signeront la validation, publiée dix jours plus tard. Surtout, une autre signature saute aux yeux : celle de Hugues Malonne en personne et notamment en tant que directeur de l’AFMPS. Etrange. « Il ne s’agissait pas de la validation en elle-même, justifie le directeur général, mais d’une explication complémentaire sur l’adaptation des cut-offs, qui permet d’améliorer les performances du test. J’ai aussi des activités académiques à l’ULB et l’UNamur. J’estimais que cela avait une valeur scientifique intéressante. »
Pas si performant…
Les cut-offs sont les seuils de valeur à partir desquels un dépistage peut être défini comme positif. Les adapter peut donc augmenter la performance de sensibilité d’un test. Dans certains cas, peu fréquents, il arrive qu’on soit amené à modifier les seuils tels que fixés par la firme productrice. Curieux tout de même que le DG de l’AFMPS signe cet article au côté de sa femme. Etait-ce nécessaire ? Curieux aussi ces cut-offs qu’on doit modifier pour améliorer un test qu’on a déjà vanté comme étant 100 % performant. Chez DiaSorin, on nous dit n’être « pas au courant de ce changement de cut-offs », ajoutant que « chaque produit de diagnostic in vitro doit être utilisé selon les instructions du fabricant ».
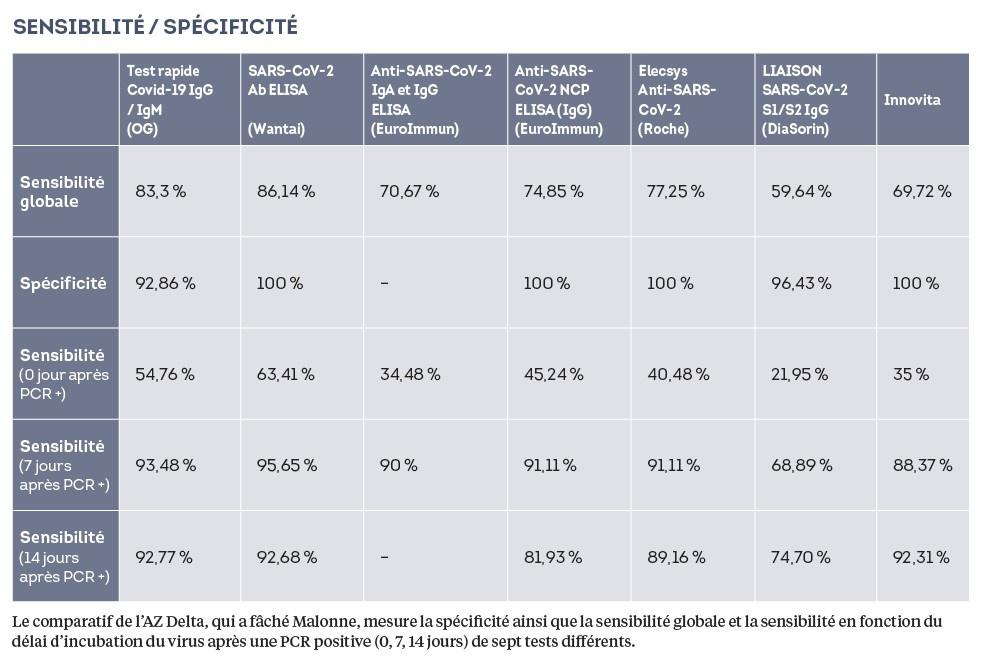
Mais ce n’est pas tout. A peu près au même moment, le laboratoire de ‘hôpital AZ Delta, à Roulers, dévoile, lors d’une autre vidéoconférence entre biologistes, les résultats d’une évaluation comparative de sept tests de dépistage d’anticorps du Covid-19, dont le DiaSorin pour lequel le labo n’a pas été mandaté par l’agence fédérale. Le produit italien s’avère, de loin, le moins performant des sept, tant au niveau sensibilité que spécificité (voir le tableau ci-contre). Cette étude « frondeuse » de l’AZ Delta est un coup de massue pour Malonne. La réaction de celui qui a négocié le contrat de 7 millions d’euros avec les Italiens ne se fait pas attendre. Il transfère l’étude directement au service Inspection de l’AFMPS. « Il y avait des erreurs grossières, dit-il. Je ne peux en parler. La direction générale Inspection est chargée d’investiguer. Ce n’est pas de mon ressort. »
A l’AZ Delta, qui est l’un des plus grands établissements hospitaliers de Belgique, on se sent injustement attaqué, on reconnaît quelques erreurs « cosmétiques » mais n’ayant aucune influence sur les résultats finaux. Le labo a d’ailleurs refait l’analyse sur le même échantillon et est arrivé à une conclusion quasi identique. Il a transmis ses données brutes à l’AFMPS tout en les publiant en ligne. Tous les biologistes y ont donc accès. D’autres laboratoires, comme le LHUB, ont aussi comparé plusieurs tests. Les différences de sensibilité/spécificité entre le DiaSorin et les autres s’y révèlent moins importantes, mais l’italien reste une fois de plus le moins performant.
Il n’est pas bien coté non plus par la « serology task force » néerlandaise qui réunit tous les labos de renom du pays. En France, il n’est pas repris dans la liste des tests homologués du ministère de la Santé. « L’hôpital Erasmus de Rotterdam et le professeur italien Mario Baldani parviennent à de très bons résultats, comme ceux du HIS », se défend Malonne. Par conscience scientifique, l’AZ Delta a réalisé une troisième évaluation du DiaSorin, sur un nouvel échantillon de patients. Les performances du test y apparaissent significativement plus élevées. Conclusion : on observe une variation de performance entre les lots de tests DiaSorin analysés. « Les variations ne sont pas anormales, cela arrive aux meilleures firmes, surtout lorsqu’on doit travailler dans l’urgence, assure Etienne Cavalier. D’où l’importance de laisser les labos valider ce qu’ils veulent et comparer leurs résultats. »
Prix élevé
L’histoire ne s’arrête pas là. Le test DiaSorin a été négocié par l’AFMPS au prix de 7 euros hors TVA. Un prix élevé par rapport à ses principaux concurrents : 5,40 euros pour Euroimmun, moins de 2 euros pour le suisse Roche et 4,85 euros pour le chinois Wantai qui, selon les évaluations, est le meilleur de sa catégorie. Le Vif/L’Express et Knack ont, par ailleurs, découvert que le prix du même test DiaSorin était de… 4 euros seulement en Italie, ce qui a suscité l’étonnement de Hugues Malonne quand nous l’avons interrogé. Il a aussitôt transféré l’info aux avocats de l’Etat, nous a-t-il écrit. Le cabinet De Backer nous a fait savoir, sans rire, qu’il renégociait un meilleur prix avec DiaSorin, depuis ce 13 juin (soit deux jours après notre entretien avec Malonne), mais que cela n’avait rien à voir avec notre enquête…
La porte-parole du ministre a également assuré que celui-ci n’était pas au courant de la situation que nous lui avons exposée et qu’il avait l’intention de demander des comptes à tous les intéressés. On a aussi appris que le contrat conclu avec DiaSorin prévoit qu’en échange de la fourniture garantie d’un million de tests, l’Etat belge s’engageait à payer ceux que les labos n’auront pas commandés. Ce contrat a été signé avant la validation du test par le labo HIS, « avec une clause de résiliation en cas d’évaluation négative », précise Malonne. Jusqu’ici, seulement 267 000 tests – soit un quart de la livraison – ont été achetés par les laboratoires de biologie. Pas sûr qu’avec la controverse sur les performances du test, ce chiffre augmente beaucoup, même en cas de deuxième vague du virus. Cela risque de coûter cher au contribuable…
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici